Des chercheurs de l’Unité Mixte de Recherche « Dynamique des génomes et Adaptation Microbienne » (UMR DynAMic, Université de Lorraine-INRAE) et de l’Université d’Exeter ont mis en évidence un mécanisme de diversification à grande échelle des voies de biosynthèse des antibiotiques chez les Streptomyces.
Publiés le 7 novembre 2024 dans la revue Molecular Biology and Evolution, ces travaux ouvrent une nouvelle voie pour l’ingénierie de nouvelles molécules d’intérêt médical, notamment de nouveaux antibiotiques. L’identification de nouvelles molécules pour combattre les pathogènes et l’antibiorésistance est cruciale en santé publique ; l’antibiorésistance devrait être responsable de 10 millions de décès dans le monde d’ici à 2050.
Une course aux armements
L’utilisation massive et le mésusage des antibiotiques favorisent l’émergence et la propagation des résistances aux antimicrobiens dans tous les réservoirs bactériens, notamment chez les pathogènes humains. La résistance aux antimicrobiens constitue un problème socio-économique majeur, reconnu par l’OMS comme « l’une des 10 plus grandes menaces pour la santé publique mondiale ». Une véritable course aux armements est en cours : il est impératif d’innover pour identifier et produire de nouvelles molécules actives capables de contrer l’adaptation des bactéries à la pression antibiotique.
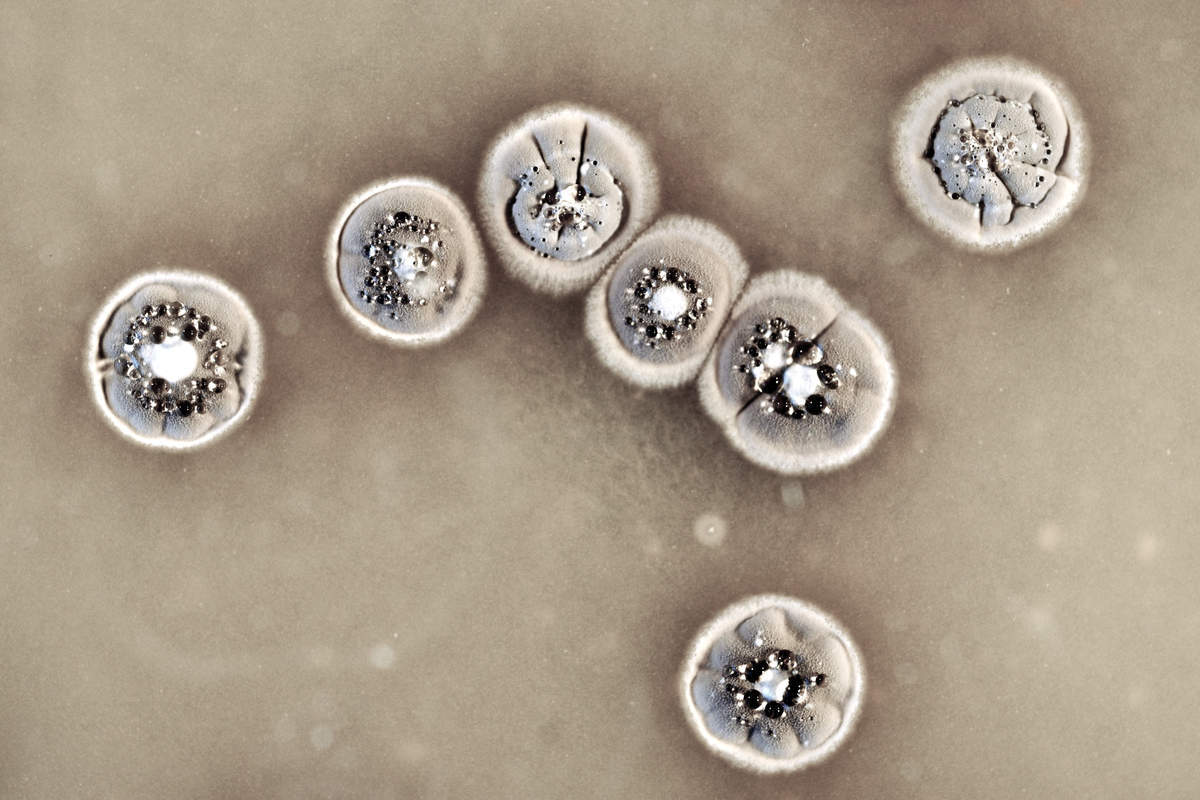
Les Streptomyces, bactéries filamenteuses vivant dans le sol, comptent parmi les « chimistes » les plus compétents de la nature grâce à leur capacité à produire une large diversité de métabolites spécialisés. Ces métabolites sont utilisés en médecine humaine et vétérinaire ainsi qu’en agronomie, incluant des molécules antibiotiques, antiprolifératives, antitumorales ou antioxydantes. Par exemple, la streptomycine produite par la bactérie Streptomyces griseus, a été découverte comme antibiotique efficace contre la tuberculose par le Pr. Selman Waksman, lauréat du Prix Nobel de Médecine en 1952 (Université Rutgers, États-Unis).
Un nouvel arsenal métabolique

Dans le cadre des travaux de thèse de Caroline Choufa (soutenue à l’Université de Lorraine en 2023), les chercheurs ont croisé des souches environnementales de Streptomyces et ont analysé le génome des descendants issus de ces croisements. Grâce à des approches de génomique (séquençage haut débit et analyse computationnelle), ils ont montré que chaque descendant présente un profil génétique très distinct de celui des parents, à l’image des descendants des croisements chez les organismes à reproduction sexuée comme l’Homme. Cette découverte est surprenante chez des bactéries dont la reproduction est principalement clonale, et où la diversification génétique se produit essentiellement par mutations et échanges de gène (transfert horizontal).
L’ampleur du phénomène est sans précédent : jusqu’à un tiers du génome de la bactérie réceptrice peut être remplacé par celui de la bactérie donatrice. Ce processus a des conséquences majeures dans la recherche de nouvelles biomolécules : ce mélange de chromosomes entraîne l’acquisition, la perte et la recombinaison de nombreux groupes de gènes impliqués dans la biosynthèse de métabolites spécialisés, créant ainsi un nouvel arsenal métabolique chez une bactérie issue d’un croisement.
Un recombinant original
Les chercheurs ont identifié le moteur de ce mécanisme : la conjugaison bactérienne, promue par le transfert d’éléments génétiques particuliers ; les AICE pour Actinomycetes Integrated and Conjugative Elements. Les AICE sont des éléments génétiques capables de passer de la bactérie donatrice à la bactérie réceptrice de façon autonome ou en emmenant avec eux des fragments chromosomiques multiples et de grandes tailles. Ces fragments se mélangent au patrimoine génétique de la bactérie réceptrice par un mécanisme de recombinaison génétique appelé recombinaison homologue (échange de segments d’ADN similaires), générant ainsi un recombinant original. Bien que ces mécanismes aient été pressentis, l’ampleur du phénomène n’était pas soupçonnée. Les auteurs ont baptisé ce phénomène le Transfert Chromosomique de Streptomyces (Streptomyces Chromosome Transfer). Cette découverte a également fait l’objet d’un article d’opinion publié le 19 septembre 2024 dans la revue Trends in Genetics avec des collègues d’universités britanniques.
Des antibiotiques essentiels dans la guerre contre les pathogènes
Cette découverte ouvre de nouvelles perspectives pour la biotechnologie et la médecine. En plus de fournir une meilleure compréhension des mécanismes de transfert et de recombinaison de l’ADN afin de mieux comprendre l’évolution et l’adaptation des bactéries du sol, elle permet d’exploiter ce phénomène pour diversifier les gènes et groupes de gènes de biosynthèse de métabolites spécialisés. Cela facilite la découverte de nouvelles biomolécules et pourrait accélérer la lutte contre les résistances bactériennes en fournissant une source constante de nouveaux antibiotiques. Le bricolage évolutif, cher à François Jacob (Le jeu des possibles, Fayard, 1981) nous surprend en fabriquant constamment du neuf à partir de l’existant, offrant ainsi une opportunité sans cesse renouvelée de découvrir de nouveaux composés bioactifs, y compris des antibiotiques, essentiels dans la guerre contre les pathogènes.
Financements : Les travaux du groupe de recherche sont soutenus par le programme Investissements d’Avenir de l’ANR (LabEx ARBRE) et LUE IMPACT Biomolécules et les programmes ANR blancs (Streptomics ANR-21-CE12-0044, MMRDNABREAK ANR-22-CE12-0042, BacNHEJ ANR-24-CE12-7675-02). Caroline Choufa a bénéficié pour sa thèse d’un co-financement Région Grand Est-LabEx ARBRE et du soutien de l’Université de Lorraine.
(source : Factuel, l’info de l’université de Lorraine)
