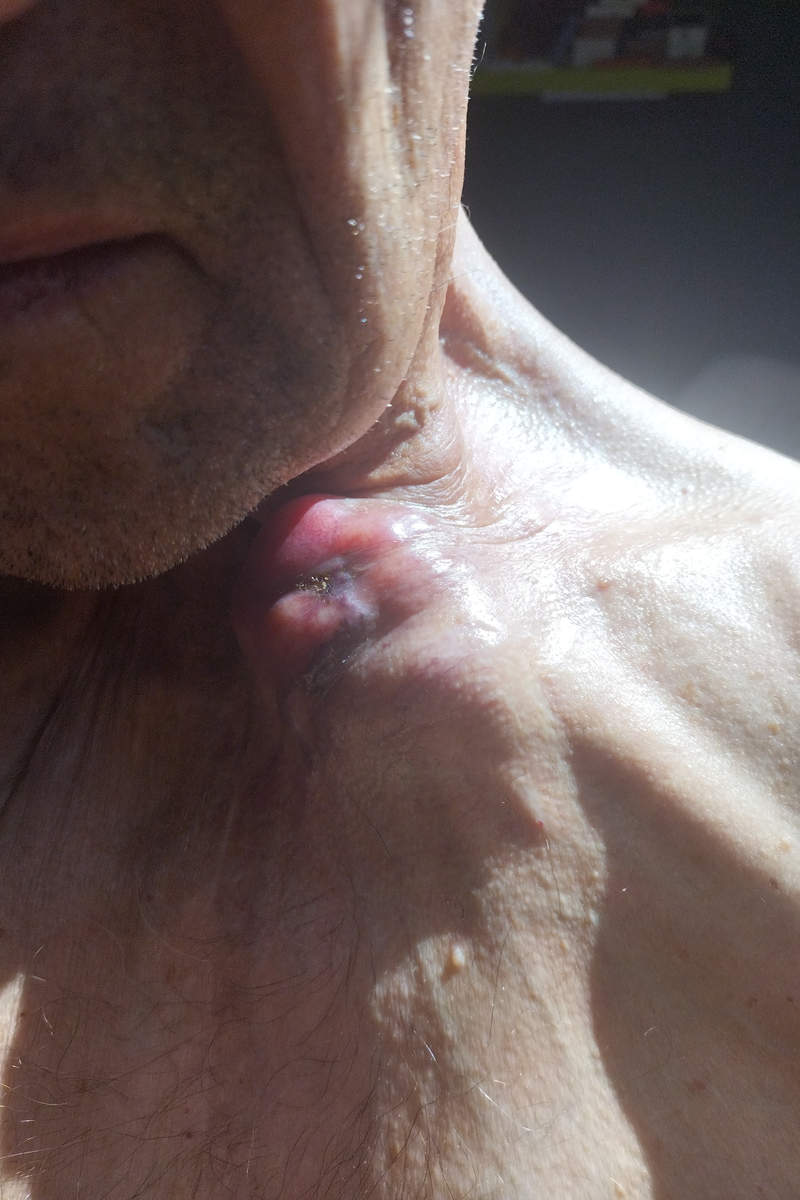
Les médecins sont confrontés de plus en plus à des phénomènes « inexpliqués » comme ceux observés aux niveaux d’anciennes cicatrices ou fractures de leurs patients, tels que le gonflement anormal du tissu conjonctif, la formation de nodules, une inflammation, et autres. Les explications de Jean-Marc Sabatier.

Par Jean-Marc Sabatier
Ces effets reposent sur le système rénine-angiotensine (SRA) -un système physiologique, ubiquitaire, hormonal et enzymatique – et sa suractivation potentielle par la protéine Spike virale (infection au virus SARS-CoV-2) ou « vaccinale » (injection du « vaccin » anti-Covid-19). Explications.
1. Rôle de la protéine Spike et du récepteur ECA2
La protéine Spike (virale ou « vaccinale ») est responsable des pathologies de la COVID-19. Elle se lie à l’enzyme de conversion de l’angiotensine 2 (ECA2) présente à la surface cellulaire pour permettre au virus de pénétrer dans les cellules humaines. Ainsi, ECA2 est un récepteur enzymatique clé du SRA lequel régule les fonctions autonomes rénales, pulmonaires, cardio-vasculaires, ainsi que l’immunité innée et les divers microbiotes. Le SRA agit donc sur la pression artérielle, le tonus vasculaire, l’inflammation, et les divers processus physiologiques qui permettent à un organisme de fonctionner correctement.
Le récepteur ECA2 est « protecteur » car il convertit l’angiotensine-2 dont l’excès est « délétère » dans l’organisme (actions pro-hypertensive, pro-inflammatoire, pro-oxydante, pro-angiogénique, pro-thrombotique, pro-hypoxémique, pro-hypoxique, pro-fibrosante, pro-hypertrophique, et qui fait chuter le monoxyde d’azote NO) en angiotensine 1-7 (dont les propriétés sont inverses et donc « bénéfiques »).
Quand la protéine Spike se lie au récepteur ECA2, elle diminue la biodisponibilité de ce récepteur conduisant à une augmentation de l’angiotensine-2 qui favorise l’inflammation, la fibrose, l’hypertrophie des organes et l’activation immunitaire.
2. Pourquoi les anciens (voire récents) sites de fracture et/ou de cicatrice sont-ils particulièrement concernés ?
Il apparait que les anciens (voire récents) sites de fracture ou de lésion tissulaire sont des zones de vulnérabilité ou de remodelage tissulaire prolongé. Le tissu conjonctif y est différent de celui environnant, avec davantage de fibroblastes, et parfois des restes de cellules inflammatoires ou d’ostéoclastes. Il peut exister une expression résiduelle élevée du récepteur ECA2 ou une régulation particulière du SRA local. Les micro-lésions ou une vascularisation altérée peuvent rendre la zone plus sensible à un déséquilibre (suractivation) du SRA. Ainsi, une interaction de la protéine Spike virale ou « vaccinale » avec le récepteur ECA2 dans ces zones peut : (i) favoriser un déséquilibre pro-inflammatoire local, (ii) stimuler les fibroblastes et produire du collagène entraînant la formation de nodules ou une fibrose, et (iii) provoquer une activation immunitaire locale responsable d’infiltration, œdème, etc.
3. Inflammation et activation immunitaire (via la protéine Spike)
La protéine Spike (notamment « vaccinale » à cause de sa forte représentation chez les personnes injectées) peut déclencher une réaction immunitaire locale exacerbée si elle est présente dans des tissus préalablement lésés (activation de l’immunité innée via les récepteurs Toll-like (TLRs), avec une production de cytokines pro-inflammatoires). Ceci peut répondre d’un gonflement du tissu conjonctif, une douleur réactivée dans d’anciennes blessures, l’apparition de nodules ou de structures fibreuses post-inflammatoires, ainsi que d’une inflammation chronique localisée.
Il peut s’agir : (i) d’un mécanisme auto-immun ou auto-inflammatoire (e.g. mimétisme moléculaire ou persistance de la protéine Spike), (ii) de la libération de molécules DAMPs (« danger-associated molecular patterns ») au niveau de tissus cicatriciels, avec une réactivation immunitaire locale, et (iii) un effet secondaire post-vaccinal ou post-infectieux sur des tissus ayant une densité anormale de récepteurs ECA2, ou de médiateurs du SRA.
Ainsi, la protéine Spike peut perturber le système rénine-angiotensine via son interaction avec le récepteur ECA2, notamment dans des tissus prédisposés comme les zones de cicatrisations ou fractures anciennes, voire récentes. Cela peut être à l’origine d’un déséquilibre pro-inflammatoire local, avec une fibrose, un gonflement, une formation de nodules, et une inflammation chronique.
L’impact de la protéine Spike sur le SRA et son rôle dans l’inflammation et la fibrose tissulaire a été exploré, notamment dans des zones de fractures anciennes, voire récentes.
L’effet « délétère » de la protéine Spike
1. Activation du SRA et inflammation vasculaire
Une étude montre que l’injection de la protéine Spike (domaine S1) chez des souris transgéniques exprimant le récepteur ECA2 humain induit une perte précoce de la thrombo-résistance endothéliale pulmonaire, suivie de dépôts de la protéine du complément C3 et d’une activation du récepteur C3aR. Cette cascade d’événements conduit à une inflammation, des lésions vasculaires, et une fibrose pulmonaire (article Scientific Reports, doi : 10.1038/s41598-023-38382-5).
2. Fibrose cardiaque (via les fibroblastes)
Une autre étude révèle que la protéine Spike (domaine S1) active les fibroblastes cardiaques humains en activant les inflammasomes NLRP3 et la voie NF-κB, dépendant de ECA2. Cette activation entraîne une migration accrue des fibroblastes et une production excessive de collagène, contribuant à la fibrose cardiaque (article Cells, doi : 10.3390/cells13161331).
3. Exacerbation de la sclérodermie systémique
Dans un modèle murin de sclérodermie systémique (maladie auto-immune chronique caractérisée par une fibrose de la peau et des organes internes, une vasculopathie et une activation anormale du système immunitaire), l’injection de la protéine Spike accélère la progression de la maladie en augmentant les cytokines inflammatoires, les cellules immunitaires Th17 (activation des fibroblastes, fibrose, inflammation), et la fibrose tissulaire. Cette réponse est associée à une la suractivation du SRA local.
Ainsi, les zones de fractures (anciennes et parfois récentes) peuvent présenter une expression résiduelle élevée du récepteur ECA2, rendant ces tissus plus sensibles aux effets « délétères » de la protéine Spike virale ou « vaccinale ». L’interaction de la protéine Spike avec ECA2 dans ces zones peut perturber le SRA local, entraînant une inflammation accrue, une activation des fibroblastes et une fibrose tissulaire (article J. Inflamm. (Lond), doi : 10.1186/s12950-023-00362-x).
En conclusion, il existe une interaction entre la protéine Spike et le récepteur ECA2 qui induit un déséquilibre du SRA (excès « délétère » d’angiotensine-2), favorisant une inflammation locale, une activation des fibroblastes, la prolifération de cellules endothéliales et musculaires lisses, ainsi qu’une fibrose et un dépôt de collagène. La protéine Spike peut stimuler l’inflammasome NLRP3 et déclencher la production de cytokines inflammatoires (IL-1β, IL-6, TNF-α, Interféron-gamma, etc.). Ces phénomènes contribuent à accentuer la réaction inflammatoire dans les tissus réparés ou fragilisés (comme les os cicatrisés ou les tendons). La protéine Spike active une enzyme (NADPH-oxydase Nox) qui produit des espèces réactives de l’oxygène (ROS) aggravant les dommages tissulaires, et stimulant les voies de fibrose (via le « Transforming Growth Factor beta » ou TGF-β) et le « Connective Tissue Growth Factor » ou CTGF).
Les pistes thérapeutiques potentielles sont : (i) les inhibiteurs du SRA : inhibiteurs de la rénine, inhibiteurs ECA, et les antagonistes du récepteur AT1R (sartans ou ARA II), (ii) les inhibiteurs de l’inflammasome NLRP3, (iii) les anti-oxydants et anti-inflammatoires (resvératrol, curcumine, quercétine (aussi inhibitrice du SRA), etc.) capables de réduire le stress oxydatif et l’inflammation, (iv) une supplémentation ciblée en vitamines et compléments alimentaires (e.g. vitamine D, magnésium, zinc, Oméga-3, etc.) pour l’immuno-modulation, l’inhibition de l’inflammation systémique, le soutien des fonctions cellulaire et immunitaire, et (v) les traitements anti-fibrosants (Pirfénidone/Esbriet et Nintedanib).
Finalement, il est démontré que l’interaction de la protéine Spike (virale ou « vaccinale ») avec le récepteur ECA2 cellulaire déclenche une cascade d’événements pro-inflammatoires et pro-fibrosants, amplifiée dans des zones déjà fragilisées (fractures ou cicatrices anciennes ou récentes, tendons altérés puis « réparés »). Des stratégies existent pour moduler le SRA, limiter l’inflammasome et freiner la fibrose, même si certaines restent expérimentales.
Ces phénomènes inexpliqués ne se limitent pas aux régions de cicatrices et de fractures, ils concernent aussi de nombreuses autres pathologies inhabituelles, voire jusqu’ici inexistantes.