
Shutterstock
François Sigaux, Commissariat à l’énergie atomique et aux énergies alternatives (CEA) – Université Paris-Saclay
La médecine occidentale, basée sur l’évidence, est un art rationnel découlant de la connaissance des causes et des mécanismes des maladies.
La France se distingue par son système de santé de haut niveau technologique et accessible à tous dans un principe de solidarité et d’équité. Elle se heurte toutefois à un modèle économique contraint et à des difficultés dues au cloisonnement des spécialités médicales et aux liens insuffisants entre l’hôpital, la médecine de ville et les acteurs sociaux. Ce n’est en outre que récemment que la prise en charge des patients tente de sortir de référentiels établis sur des données moyennes, gommant les spécificités de chacun, pour aller vers la médecine de précision qui constitue le nouveau paradigme des soins.
Notre médecine actuelle fait probablement aussi une place insuffisante à la prévention, non par volonté politique, mais par difficulté à convaincre les citoyens. On peut espérer que la médecine du futur, en France et ailleurs, puisse devenir plus prédictive, préventive, participative et de précision.
La refonte de l’organisation du système de soins aidera à le décloisonner et à mieux préciser la place des acteurs réels et virtuels autour du patient dans une vision de démocratie sanitaire.
Explorer le génome, les métagénomes et l’exposome pour une médecine de précision, prédictive et préventive
Génome, métagénomes et exposome façonnent ce que nous sommes et conditionnent largement la prévalence et les particularités des maladies de chacun.
La place cruciale du génome et de ses épigénomes dans le développement de l’individu et la définition du soi est validée expérimentalement depuis longtemps. Toutefois, ce n’est que depuis quelques décades que ces données ont envahi la recherche sur la santé et la pratique de la médecine. Des domaines clés que constituent la transplantation de moelle osseuse et d’organe, les maladies rares à transmission génétique mono-factorielle et les cancers, l’intérêt des chercheurs s’est tourné vers d’autres maladies fréquentes multifactorielles.
NIH/DR
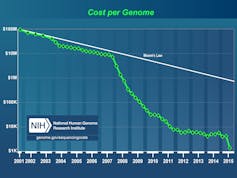
Le poids des gènes dans la prévalence et les formes cliniques commence à être établi avec, en toile de fond, la complexité apportée par les variations génétiques des populations entre elles. Ce champ de recherche a été bouleversé par les évolutions technologiques et la diminution du coût du séquençage qui mettent à portée du médecin l’utilisation clinique des approches génomiques et facilite l’interprétation de celles qui en sont proches – transcriptomique, protéomique, métabolomique.
Éviter l’errance diagnostique qui frappe les familles atteintes de maladies génétiques, adapter le traitement des cancers sur la base du génome de l’individu et de la tumeur, mieux comprendre et peut-être prédire et prévenir les maladies courantes multifactorielles, c’est la feuille de route que s’est donnée la France dans le Plan France Médecine Génomique 2025 (PFMG).
Récemment encore, chercheurs et médecins se sont réapproprié la notion que l’homme ou les autres éléments du vivant sont des êtres symbiotiques. Il serait artificiel de considérer l’homme indépendamment des micro-organismes qui peuplent l’intestin, la peau et les muqueuses. Ces micro-organismes échangent des signaux avec notre organisme et jouent des rôles déterminants dans nombre de maladies comme l’obésité ou certaines maladies neurologiques ou psychiatriques. Ces germes peuvent être aussi critiques pour l’efficacité des thérapeutiques, telle l’immunothérapie des cancers. Evaluer la diversité de nos microbiotes par les approches « -omiques » pourrait utilement compléter les outils du PFMG dans le futur.
Si la génomique définit le champ des possibles pour chaque individu depuis la conception, ce que nous sommes à tous les âges de la vie, est largement déterminé par notre exposition au monde extérieur par notre mode de vie et ses déterminants sociaux, notre environnement au travail et plus généralement par l’environnement tout court, largement marqué par l’homme depuis la période industrielle. Le corps est façonné par l’alimentation (que l’on peut par extension considérer comme une exposition). Il est altéré par l’exposition aux toxiques ou par la rencontre avec des agents infectieux ou leurs vecteurs. Dans ce contexte, il est clair que la santé humaine ne peut être isolée d’une santé plus globale qui inclut l’ensemble du vivant (« One Health »).
Recueillir et intégrer ces données aux éléments cliniques et aux données quantitatives issues de l’imagerie clinique in vivo est un enjeu majeur de la médecine du futur de précision. Ceci ne peut se faire que par le développement d’une filière industrielle spécialisée de dispositifs médicaux pour interroger le génome, l’épigénome et l’exposome, filière pour laquelle le Centre de référence, d’innovation, d’expertise et de transfert (CREFIX) du PFMG devrait être une première brique et un orchestrateur majeur.
Placer le malade, le médecin et leurs avatars en situation clinique pour une médecine numérique participative, transparente et équitable
De nombreux schémas organisationnels de médecine individuelle sont possibles, allant jusqu’à la disparition des professionnels de santé remplacés par des algorithmes et des dispositifs de diagnostic et de soins fournis par des sociétés industrielles à partir d’un catalogue mondial. Moins ambitieux mais garant de l’équité, le scénario que je suggère conserve une relation entre malade et médecin, êtres sensibles, tout en incorporant des compagnons technologiques qui optimisent la démarche commune.
Dans ce modèle, sont associés au malade une représentation digitale ou jumeau numérique et un compagnon biologique qui regroupe l’ensemble des ressources personnalisées extraites ou construites à partir de son corps. Le médecin, pour sa part, est épaulé par la représentation digitale de ses connaissances et de ses règles de décision (médecin digital). Lui sont également associés des capteurs et outils diagnostiques qui construisent le patient digital en convertissant les données biologiques, d’imagerie ou cliniques en fichiers numériques.
Pour intervenir sur le patient, le médecin dispose d’approches classiques (médicaments, actes chirurgicaux, agents physiques, rééducation, psychothérapie), enrichis de technologies émergentes. Médecin digital et patient digital en interaction avec l’espace des connaissances, optimisent l’aide à la décision partagée par le malade et le médecin qui, débarrassés des détails techniques, devraient disposer du temps nécessaire pour trouver un langage commun dans un principe de médiation, de transparence et d’équité.
Construire, avec le tissu industriel, les trois piliers technologiques d’une médecine intégrée, source de développement économique
La médecine du futur sera très fortement impactée par trois piliers technologiques, sources majeures de recherches et de développement économique.
Le premier pilier est celui des approches multidisciplinaires de développement des dispositifs médicaux à usage diagnostique, thérapeutique ou mixte. Ils bénéficieront de la chimie, de la biologie de synthèse, de différentes physiques dont l’électronique et la science des matériaux, de la robotique, des nanotechnologies et des sciences de l’information.
Le deuxième pilier est celui du compagnon biologique regroupant tous les développements biotechnologiques personnalisés construits à partir d’éléments du corps du malade tels le développement d’organes sur puces ou encore la modification génétique de cellules à des fins de médecine de précision.
Le dernier pilier, enfin, est numérique, intégrateur de la médecine du futur et bâtisseur d’un système de santé doté d’autoapprentissage.
Nano-objets hybrides, interfaces « vivant-électronique » et robotique
Les nanotechnologies tiennent déjà une place importante en médecine. Dans le domaine du diagnostic, elles sont cruciales pour augmenter la sensibilité de l’imagerie in-vivo dont l’objectif ultime (notamment pour l’imagerie par résonance magnétique) est la visualisation à l’échelle de la cellule. En thérapeutique, les nano-objets sont utilisés pour la délivrance de principes actifs ou pour augmenter l’efficacité de la radiothérapie dont les modalités évoluent avec les avancées technologiques et celles de la radiobiologie.
À lire aussi :
La nano-imagerie, un nouvel outil pour la médecine moderne
La possibilité de coupler au sein d’un même objet des dispositifs issus de la biologie synthétique et de l’électronique pourrait ouvrir la voie à des objets communicants multifonctionnels, à la fois capteurs de données biologiques et physiques et outils thérapeutiques délivrant de façon raisonnée des principes actifs. Dans ce contexte, le développement d’une électronique biocompatible et, le cas échéant, biodégradable, sera une étape clé.
Le vieillissement de la population augmente le nombre de patients atteints de maladies dégénératives pour lesquelles les thérapeutiques restent peu efficaces. Ces maladies entraînent des handicaps majeurs. Au-delà de fournir des organes de substitution, comme la rétine artificielle, ou des exosquelettes, la médecine devra accompagner les personnes handicapées pour améliorer leur bien-être dans leur environnement habituel. La conception de robots les aidant dans leur vie quotidienne sera cruciale dans ce cadre.
Outre des développements technologiques, l’élaboration de ces robots demandera d’importants développements d’algorithmes d’intelligence artificielle participant à la création d’un lieu de vie personnalisé, intelligent et connecté. De plus en plus, les robots pilotables à distance accompagneront les chirurgiens dans une pratique de moins en moins invasive, bénéficiant d’une vision augmentée du champ opératoire et d’une simulation préopératoire personnalisée basée sur les données d’imagerie du patient.
Compagnon biologique du patient et reconstruction des tissus et organes
Les avancées considérables de la recherche sur les cellules souches permettent d’obtenir in vitro pratiquement tous les types de cellules qui constituent l’organisme. Les progrès en biotechnologie et notamment dans la bio-impression 3D ouvrent la voie vers la reconstruction de tissus et d’organes dont les fonctions biologiques sont conservées. Elles permettent également de reconstruire des tumeurs malignes à l’image de celle du patient.
À l’échelon individuel, ces compagnons biologiques peuvent être utilisés pour l’optimisation des traitements personnalisés en étudiant ex vivo l’effet des thérapeutiques, les données obtenues enrichissant l’avatar du patient. Les organes reconstitués pourront également être réimplantés chez le patient donneur sans rejet immunitaire, diminuant le recours aux organes prélevés sur cadavres.
À lire aussi :
Les « compagnons biologiques », un atout pour la médecine du futur
La constitution de collections d’un grand nombre de compagnons biologiques annotés par la séquence du génome de l’individu, permettra de simuler des essais thérapeutiques ex vivo et diminueront les risques de toxicité et d’inefficacité.
La médecine numérique, intégrateur de la médecine du futur
La possibilité de convertir pratiquement toutes les données médicales (clinique, génomique, imagerie par exemple) en données digitales compréhensibles par un ordinateur (le patient digital) ouvre la voie à une nouvelle médecine basée sur ces données.
Dans ce contexte, la relation médecin-malade est une confrontation du monde réel et d’un monde virtuel où interagissent trois partenaires : la connaissance scientifique et les données, la représentation numérique du malade (patient digital ou jumeau numérique) et les algorithmes d’intelligence artificielle (ou médecin digital). Ces derniers interprètent le patient digital et fournissent une aide à la décision médicale en proposant des recommandations diagnostiques et thérapeutiques de précision. Le médecin devient un médiateur critique de l’information et reste le garant du caractère humain de cette nouvelle médecine.
L’inclusion des cohortes de patients numériques dans un collecteur et analyseur de données (comme le CAD du PFMG) permettra d’appliquer des algorithmes basés sur l’intelligence artificielle, la science des données et la simulation des processus biologiques qui guideront le médecin et le patient dans la définition d’une prise en charge optimale.
Les données de tous seront au service de chacun, contribuant, par l’expertise collective, à une médecine personnalisée et moins dépendante de l’expérience d’un seul médecin ou d’une seule équipe médicale. Au-delà de la prise en charge des maladies, cette médecine numérique s’appliquera aussi à la prédiction et à la prévention notamment via les objets connectés réalisant un Internet de santé.
Il est probable que la question du séquençage du génome de tous les individus se posera un jour, faisant l’objet de débats éthiques et poussant à l’évolution des lois et règlements. La variabilité des génomes définit les populations et constitue une ressource patrimoniale. Son analyse peut permettre d’anticiper à l’échelon individuel et collectif la capacité de réagir au milieu ambiant. Il s’agit donc de données qui doivent être conservées dans un lieu hautement sécurisé offrant toutes les garanties contre une utilisation frauduleuse ou malveillante.
Imaginer les innovations des trois piliers de la médecine du futur et les conduire jusqu’au patient demande une interaction efficace entre professionnels de santé, chercheurs académiques et industriels et entreprises qui puissent les mettre sur le marché. Des innovations organisationnelles sont nécessaires. Des propositions en ce sens ont été faites dans le rapport « Médecine du futur ».
Cet article est publié en partenariat avec le CEA, qui consacre le numéro 67 de son magazine Clefs à la médecine du futur. Il a également été publié dans la revue Hématologie (2018 ; 24(6)).![]()
François Sigaux, PU-PH, Université Paris Diderot et APHP, Directeur scientifique, Commissariat à l’énergie atomique et aux énergies alternatives (CEA) – Université Paris-Saclay
Cet article est republié à partir de The Conversation sous licence Creative Commons. Lire l’article original.
![]()
