
Arteida Mjeshtri/Unsplash, CC BY-SA
Pan Dan, Université de Lorraine; Patrick Menu, Université de Lorraine et Véronique Decot, Université de Lorraine
L’arrivée d’un nouveau-né est un moment de bonheur et personne ne fait attention au placenta et ses annexes comme le cordon ombilical : lien le plus fondamental entre la mère et l’enfant.
Bien que les cordons ombilicaux ne soient pas encore valorisés dans la plupart des maternités dans le monde, ses potentialités dans la médecine régénérative sont des plus reconnues.
La loi française autorise le don des tissus périnataux pour autrui, à finalité thérapeutique ou scientifique, avec le consentement de la mère. Le cordon ombilical sur lequel nous travaillons contient ainsi des tissus d’origine humaine qui se révèlent être des trésors pour la médecine régénérative.
Un cordon ombilical présente une veine et deux artères parallèles qui sont entourées d’une fine membrane et d’une matrice gélatineuse appelée gelée de Wharton. Celle-ci est connue pour sa richesse en cellules souches mésenchymateuses, un type de cellules très utilisé dans le domaine de l’ingénierie tissulaire de par ses capacités de renouvellement et de différenciation vers des cellules spécifiques.
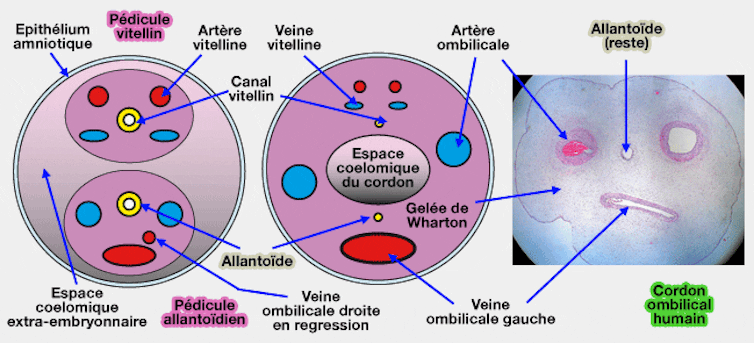
vetopsy.fr
Initialement, les cellules souches mésenchymateuses étaient prélevées de la moelle osseuse. Le cordon ombilical offre la possibilité d’un prélèvement facile de cellules souches mésenchymateuses en grande quantité. De plus, le cordon ombilical est considéré comme appartenant au tissu périnatal, les cellules souches qu’il contient sont aussi plus jeunes que les cellules issues de la moelle osseuse.
Ces cellules en font donc des acteurs de choix pour être utilisées en ingénierie tissulaire puisqu’elles ont la capacité de « devenir » des cellules propres à un organe et d’en avoir les fonctions spécifiques.
Aux origines de l’ingénierie tissulaire vasculaire
Il y a plus d’un siècle, le Dr Alexis Carrel comprenait, chez des patients souffrant de maladie cardiaque, l’association entre l’angine de poitrine et la sténose coronarienne.
Carrel a reçu le prix Nobel de physiologie et de médecine en 1912. Dès lors, les traitements chirurgicaux pour les maladies cardiovasculaires, en particulier les pontages aorto-coronariens, ont beaucoup progressé.
Chaque année en France, plus que 25 000 patients bénéficient d’un pontage coronarien. Cependant, la potentialité de greffons vasculaires naturels est limitée. Bien que les artères ou les veines isolées d’un malade soient la source vasculaire préférentielle pour ce traitement, leur indisponibilité pour une telle application est souvent constatée en clinique, en particulier pour des patients atteints de diabète ou de maladies vasculaires périphériques.
Le praticien doit donc se tourner vers des vaisseaux exogènes, qui ne répondent pas à toutes les attentes. Aussi, l’ingénierie vasculaire apparaît comme une alternative intéressante, car elle pourrait permettre la production en grand nombre de vaisseaux prêts à être implantés tout en respectant ses qualités et fonctionnalités.
Le principe de l’ingénierie tissulaire repose sur trois acteurs interdépendants : des cellules, une matrice (naturelle ou synthétique) pouvant les héberger, et un environnement favorable à leur développement : à la fois chimique (facteur de croissance, teneur en oxygène…) et physique (pression, cisaillement…).
Cellules souches et ingénierie vasculaire
L’objectif de l’ingénierie vasculaire est de construire un greffon vasculaire constitué de cellules vasculaires et d’une matrice extracellulaire (sorte de structure organisée) sous forme de tube dans laquelle les cellules peuvent se loger, s’organiser et interagir aux sollicitations du flux sanguin.
L’ingénierie commence par l’isolement des cellules, puis une amplification in vitro pour en avoir une quantité suffisante avant de les déposer sur une matrice.
En les combinant avec des biomatériaux de forme tubulaire, il est alors possible de former un greffon vasculaire cellularisé mais cela demande un temps de maturation des cellules de plusieurs semaines (avec un risque majeur de perdre leurs fonctionnalités).

Auteur, Author provided
Quand bien même, l’idéal serait alors de prélever des cellules du patient, ce qui donnerait un greffon cellularisé prêt à lui être implanté sans risque majeur de rejet. Cependant, les résultats rapportés dans la littérature sont assez décevants, en particulier du fait que les cellules utilisées sont déjà « matures » et qu’elles perdent progressivement leurs fonctionnalités au cours de leurs divisions successives, nécessaires pour augmenter leur nombre.
Pour contourner cet écueil, nous pouvons utiliser des cellules souches mésenchymateuses qui sont reconnues comme faiblement immunogènes (qui théoriquement n’entraînent pas de rejet après implantation) et susceptibles de devenir des cellules spécifiques du vaisseau.
Ces cellules constituent donc un axe majeur dans l’élaboration d’un nouveau biomatériau cellularisé. Reste à définir le support sur et dans lequel ces cellules vont se loger. L’idéal est de trouver un support naturel et, dans la mesure du possible, d’origine humaine, pour fabriquer un biomatériau qui peut fournir un environnement favorable au développement des cellules souches.
Le bon terreau pour la culture des cellules souches
Nous avons développé au sein de notre groupe du laboratoire IMoPA un substitut vasculaire cellularisé et totalement d’origine humaine, qui contient à la fois des cellules souches et une matrice d’origine vasculaire. Toutes deux provenant du cordon ombilical.
L’utilisation du cordon ombilical est d’autant plus aisée que ce tissu d’origine humaine n’est pas actuellement valorisé. Pourtant, la gelée de Wharton qui le constitue, est à la fois une niche de cellules souches et un environnement naturel pour ces cellules. Par conséquent, il nous est paru intéressant de fabriquer un biomatériau à base de la gelée de Wharton dans lequel les cellules souches isolées se sentent chez elles pour le coloniser.
Cette surface est utilisée pour cultiver les cellules souches, un peu comme un terreau est déposé sur un sol aride pour cultiver des légumes. La surface recouverte de la gelée de Wharton montre un effet favorable à l’adhésion et à la prolifération des cellules souches. De plus, cette surface favorise la différenciation des cellules souches en un type de cellules vasculaire (appelées cellules endothéliales) localisées sur la surface interne du vaisseau, qui empêchent en autre la formation de caillots sanguins.
Kaibara87/Flickr, CC BY
Dans notre corps, les cellules endothéliales sont soumises à un flux sanguin constant, dont les forces de cisaillement nécessitent une adhésion forte des cellules à leur surface pour ne pas être arrachées. Nous avons d’ailleurs montré dans un modèle in vitro utilisant un réacteur capable de mimer les conditions de flux sanguin de notre corps, que les cellules cultivées sur une surface préparée à partir de la gelée de Wharton adhérent davantage en comparaison de conditions standards.
Forts de ces observations, nous avons recouvert d’une solution de la gelée de Wharton la surface interne d’une matrice obtenue par décellularisation d’une artère ombilicale. Les cellules souches mésenchymateuses sont alors ensemencées sur cette surface. Pour valider la fonctionnalité vasomotrice de cette artère ainsi construite, nous l’avons implantée au niveau de la carotide de lapin et vérifié la dynamique du flux sanguin dans le greffon.
Après trois semaines d’implantation, nous avons constaté que les artères traitées par la gelée de Wharton étaient toutes perméables et présentaient un débit sanguin comparable au témoin, alors que l’absence de cellules conduisait à une thrombose précoce. Ceci met en évidence que la gelée de Wharton est une excellente matrice naturelle d’origine humaine, facile à extraire et à moindre coût, qui permet à la fois une adhésion forte des cellules, leur prolifération et leur différenciation, ce qui en fait un candidat prometteur pour l’ingénierie tissulaire.
![]() Les résultats très prometteurs nous amènent à valider les performances de ce greffon par un pontage coronarien chez le cochon. In fine, cette étude vise à alimenter une banque de prothèses vasculaires de grade clinique disponibles pour réaliser des pontages par voie mini-invasive assistée d’un robot qui a l’avantage de suppléer une déficience en artères autologues et de réduire l’impact traumatisant d’une telle intervention.
Les résultats très prometteurs nous amènent à valider les performances de ce greffon par un pontage coronarien chez le cochon. In fine, cette étude vise à alimenter une banque de prothèses vasculaires de grade clinique disponibles pour réaliser des pontages par voie mini-invasive assistée d’un robot qui a l’avantage de suppléer une déficience en artères autologues et de réduire l’impact traumatisant d’une telle intervention.
Pan Dan, Médecin chercheur, Université de Lorraine; Patrick Menu, Professeur de physiologie et physiopathologie à la faculté de pharmacie de Nancy, Université de Lorraine et Véronique Decot, Maitre de conferences et praticien hospitalier au CHRU de Nancy, Université de Lorraine
La version originale de cet article a été publiée sur The Conversation.
![]()
