
Clara Roujeau, Université de Lausanne
« Les gros n’ont qu’à moins manger et s’activer un peu plus pour perdre du poids ». Cette phrase, on l’a déjà tous entendue. Est-ce si simple ? Des études scientifiques montrent que la suralimentation ainsi que la consommation de plats trop riches en graisses (lipides) et en sucres (glucides) provoquent des modifications au niveau du cerveau. La fonction neuronale impliquée dans la régulation de la prise alimentaire est alors altérée.
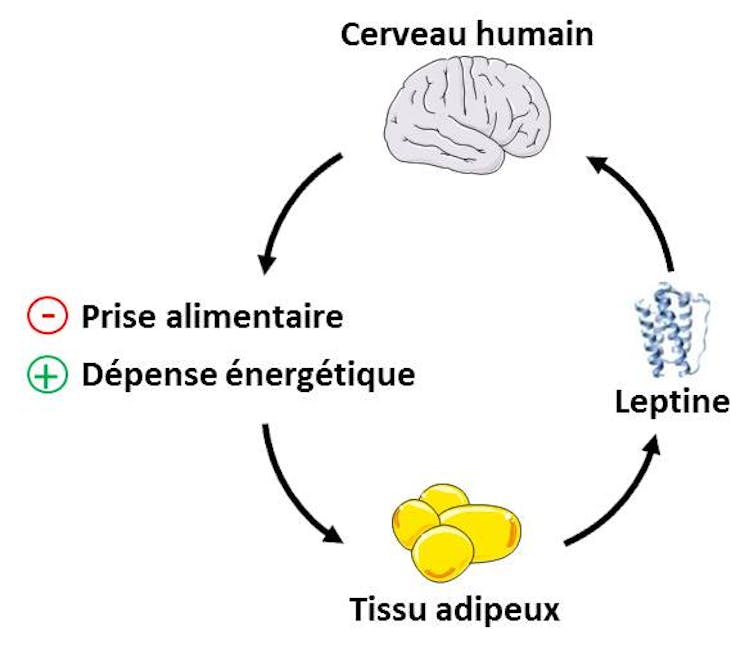
Un cercle vicieux se crée dont les trois composantes majeures sont malbouffe, fonction neuronale détériorée et sensation de satiété dérégulée. La leptine est une hormone dont la fonction neuronale est altérée au cours de ce cercle vicieux.
Une pandémie d’obésité
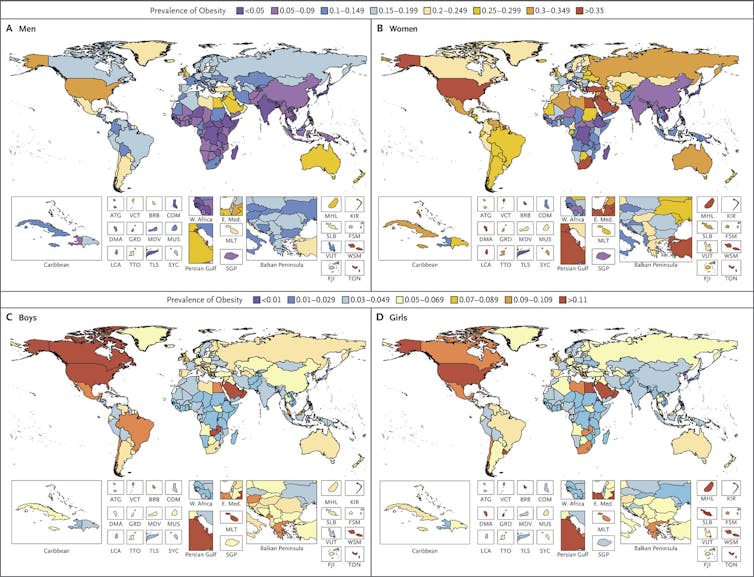
Une étude très récente, publiée par la prestigieuse revue médicale New England Journal of Medicine, révèle que 12 % de la population mondiale est obèse, et qu’un homme sur trois est en surpoids !
New England Journal of Medecine
La France se démarque en comptabilisant notamment 44 % d’hommes en surpoids ! Des chiffres inquiétants, étant donnée l’association entre l’obésité et de nombreuses pathologies telles que le diabète de type II, des cancers et autres maladies cardiovasculaires. Il apparaît donc crucial de comprendre les causes et les dérégulations physiologiques à l’origine de l’obésité, afin d’élaborer des stratégiques thérapeutiques efficaces sur le long terme pour enrayer cette pandémie.
La leptine : notre coupe-faim naturel
La balance énergétique correspond à l’équilibre entre la prise alimentaire (énergie absorbée lors des repas) et les dépenses énergétiques (énergie éliminée lors des exercices physiques ou de notre métabolisme pour maintenir la température corporelle par exemple). Une dérégulation du maintien de cette balance énergétique entraîne des situations pathologiques, telles que l’obésité.
La leptine joue un rôle clé dans le contrôle de la balance énergétique. Cette hormone est fabriquée et relarguée dans le sang par le tissu adipeux (graisses du corps), notamment après un repas.
Après avoir atteint le cerveau, la leptine régule l’activité de certains neurones provoquant une sensation de satiété : la prise alimentaire est alors diminuée (on parle d’effet anorexigène).
Dans le même temps, la leptine augmente les dépenses énergétiques en stimulant la mobilisation des graisses. L’action cérébrale de la leptine vise donc à maintenir la masse grasse et le poids corporel.
Author provided
Afin de contrôler l’activité neuronale, la leptine se lie sur des protéines : les récepteurs OBR localisés à la surface des neurones. Ces récepteurs OBR sont absolument requis pour transmettre l’information portée par la leptine aux neurones, et donc le maintien de la balance énergétique. En effet, des mutations génétiques provoquant une déficience en leptine ou en ces récepteurs OBR entraînent une obésité sévère dite morbide.
Tous égaux devant la leptine ?
Ces mutations génétiques sont extrêmement rares. Au contraire, la majorité des patients obèses ont des taux très élevés de leptine dans le sang. Ce qui est logique puisque la masse grasse est fortement augmentée chez ces patients et que cette molécule est fabriquée par le tissu adipeux.
En revanche, de façon surprenante, les patients obèses sont incapables de répondre à ces taux élevés de leptine, puisqu’ils ne perdent pas de poids et que leur balance énergétique reste altérée.
Les neurones sont en fait « insensibles » à la leptine : c’est la « résistance à la leptine ». Des chercheurs ont montré que ce phénomène peut être une conséquence de mauvaises habitudes alimentaires. En effet, des régimes prolongés riches en graisses et en sucres (type malbouffe) peuvent entraîner des modifications de la barrière entre sang et cerveau altérant le transport de la leptine jusqu’à ses cibles neuronales. D’autres modifications touchent par exemple les récepteurs OBR, empêchant alors l’activation des neurones par la leptine.
Un nouvel acteur associé à la malbouffe
Nous avons découvert la protéine Endospanine 1, localisée dans les mêmes neurones que les récepteurs OBR ciblés par la leptine.
Endospanine 1, en formant un complexe physique avec les récepteurs OBR, les retient à l’intérieur des neurones. Endospanine 1 diminue donc le nombre de récepteurs OBR à la surface de ces neurones accessibles à la leptine. Il en résulte une baisse de la transmission de l’information portée par la leptine aux neurones. Ainsi, Endospanine 1 altère l’activation de ces neurones par la leptine, provoquant une dérégulation du contrôle de la balance énergétique.

Author provided
Nous avons montré chez des souris qu’un régime riche en graisses augmente le nombre de protéines Endospanine 1 dans le cerveau. Ainsi, une alimentation de type malbouffe provoque des modifications physiologiques conduisant, entre autres, à une hausse de la quantité de protéines Endospanine 1 dans les neurones.
Plus de récepteurs OBR sont alors retenus à l’intérieur de ces neurones, qui deviennent donc insensibles à l’effet anorexigène de la leptine. Endospanine 1 pourrait donc participer à l’établissement de ce cercle vicieux malbouffe – fonction neuronale détériorée – sensation de satiété dérégulée.
Un remède inédit à l’obésité ?
Étant donné qu’Endospanine 1 semble jouer un rôle délétère dans la sensibilité des neurones à la leptine, nous nous sommes posé la question suivante : la suppression d’Endospanine 1 dans ces neurones serait-elle suffisante pour prévenir voire corriger le développement d’une obésité ? Pour tester cette hypothèse, nous avons injecté dans le cerveau de souris une molécule spécifique (appelée shRNA pour short hairpin ribonucleic acid) qui permet d’éliminer les protéines Endospanine 1 dans les neurones ciblés.
Ces injections de shRNA ont été réalisées soit sur des souris normales, soumises à un régime riche en graisses après l’injection ; soit sur des souris déjà obèses car soumises à ce régime riche en graisses avant l’injection.
Nous avons observé que les souris injectées prennent moins de poids que les souris non-injectées en réponse au régime riche en graisses.
Ainsi, la suppression d’Endospanine 1 dans le cerveau permet d’empêcher le développement d’une obésité chez des souris soumises à un régime gras. En outre, elle permet de corriger l’obésité des souris soumises au régime gras avant l’injection, et ce sur le long terme lorsque l’injection est combinée à un retour à un régime classique.
![]() Ces résultats très prometteurs chez la souris suggèrent qu’Endospanine 1 pourrait être une cible thérapeutique de choix pour la prévention et le traitement de l’obésité. Toutefois, le chemin reste encore long pour valider cette stratégie thérapeutique chez l’homme.
Ces résultats très prometteurs chez la souris suggèrent qu’Endospanine 1 pourrait être une cible thérapeutique de choix pour la prévention et le traitement de l’obésité. Toutefois, le chemin reste encore long pour valider cette stratégie thérapeutique chez l’homme.
Clara Roujeau, Postdoctoral research fellow, Université de Lausanne
La version originale de cet article a été publiée sur The Conversation.
![]()
